فئات: مقالات مميزة » كهربائيين المبتدئين
مرات المشاهدة: 36288
تعليقات على المقال: 1
مصادر التيار الكيميائي: الخصائص الرئيسية
 لأكثر من قرنين من الزمان ، تستخدم البشرية طاقة التفاعلات الكيميائية بين المواد المختلفة لإنتاج تيار مباشر.
لأكثر من قرنين من الزمان ، تستخدم البشرية طاقة التفاعلات الكيميائية بين المواد المختلفة لإنتاج تيار مباشر.
مبدأ العمل
يكون تفاعل الأكسدة والاختزال الذي يحدث بين المواد ذات خواص العامل المؤكسد وعامل الاختزال مصحوبًا بتحرير الإلكترونات ، التي تشكل حركتها تيارًا كهربائيًا. ومع ذلك ، من أجل استخدام طاقتها ، من الضروري تهيئة الظروف لمرور الإلكترونات عبر دارة خارجية ؛ وإلا ، يتم إطلاقها عن طريق الحرارة من مزيج بسيط من عامل مؤكسد وعامل اختزال.
لذلك ، جميع مصادر التيار الكيميائي لها قطبين:
-
الأنود الذي يحدث فيه الأكسدة ؛
-
الكاثود ، وتنفيذ استعادة للمادة.
يتم وضع الأقطاب الكهربائية على مسافة في وعاء به إلكتروليت - مادة تقوم بتوصيل التيار الكهربائي بسبب عمليات تفكك الوسيط إلى أيونات.
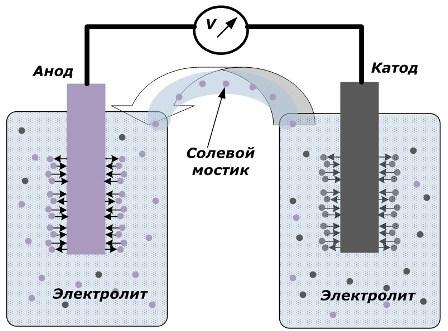
مبدأ تحويل الطاقة الكيميائية إلى طاقة كهربائية
يوضح الشكل أن الأقطاب الكهربائية توضع في أوعية منفصلة متصلة بواسطة جسر ملح يتم من خلالها إنشاء حركة الأيونات على طول الدائرة الداخلية. عندما تكون الدوائر الخارجية والداخلية مفتوحة ، تحدث عمليتان على الأقطاب الكهربائية: انتقال الأيونات من معدن القطب إلى المنحل بالكهرباء وانتقال الأيونات من المنحل بالكهرباء إلى الشبكة البلورية للأقطاب.
معدلات تدفق هذه العمليات هي نفسها ويتم تجميع إمكانات الجهد للعلامات المعاكسة على كل قطب كهربائي. إذا كانت متصلة من خلال جسر الملح وتطبيق الحمل ، ستحدث دائرة كهربائية. يتم توليد تيار داخلي بواسطة حركة الأيونات بين الأقطاب الكهربائية عبر المنحل بالكهرباء وجسر الملح. حركة الإلكترونات على طول الدائرة الخارجية في الاتجاه من الأنود إلى الكاثود.
تقترن جميع تفاعلات الأكسدة تقريبا بتوليد الكهرباء. لكن قيمتها تعتمد على العديد من العوامل ، بما في ذلك أحجام وكتل المواد الكيميائية المستخدمة ، والمواد المستخدمة في صنع الأقطاب الكهربائية ، مثل الإلكتروليت وتركيز الأيونات والتصميم.
الأكثر استخداما في مصادر التيار الكيميائي الحديثة هي:
-
للمواد من الأنود (عامل الاختزال) والزنك (Zn) والرصاص (Pb) والكادميوم (Cd) وبعض المعادن الأخرى ؛
-
للمواد الكاثودية (المؤكسد) - أكسيد الرصاص PbO2 ، أكسيد المنغنيز MnO2 ، هيدروكسيد النيكل NiOOH وغيرها ؛
-
الشوارد القائمة على حلول الأحماض والقلويات أو الأملاح.
طرق التصنيف
يمكن إعادة استخدام جزء من مصادر الطاقة الكيميائية ، بينما لا يمكن إعادة استخدام الجزء الآخر. يؤخذ هذا المبدأ كأساس لتصنيفهم.
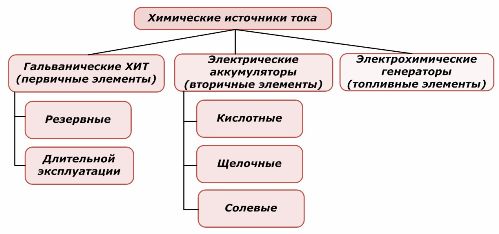
تصنيف العناصر الكيميائية
القوة الدافعة الكهربائية خلايا كلفانية، حسب التصميم ، يصل إلى 1.2 ÷ 1.5 فولت. للحصول على قيم كبيرة ، يتم دمجها في بطاريات متصلة في سلسلة. عندما تكون البطاريات متصلة بالتوازي ، تزداد الطاقة الحالية.
من المقبول عمومًا أن مصادر التيار الكيميائي الأولية لا تدعم إعادة الشحن ، على الرغم من أن هذا الموقف بدقة أكثر يمكن صياغته بشكل مختلف: تنفيذه ليس مجديًا اقتصاديًا.
يتم تخزين مصادر التيار الكيميائية الأولية الزائدة في حالة يتم فيها عزل المنحل بالكهرباء من الأقطاب الكهربائية. هذا يلغي حدوث تفاعل الأكسدة والاختزال ويضمن الاستعداد للتكليف. لا يتم إعادة استخدامها. العمر الافتراضي لمصادر الطاقة الاحتياطية الكيميائية محدود بـ 10-15 سنة.
يتم إعادة شحن البطاريات بنجاح من خلال تطبيق الطاقة الكهربائية الخارجية. بسبب هذه الميزة ، يطلق عليها المصادر الحالية الثانوية. إنهم قادرون على تحمل مئات وآلاف دورات تفريغ الشحنة.يمكن أن تكون البطارية EMF في حدود 1.0 ÷ 1.5 فولت. يتم دمجها أيضًا في البطاريات.
تعمل المولدات الكهروكيميائية على مبدأ الخلايا الكلفانية ، ولكن لتنفيذ التفاعل الكهروكيميائي ، تأتي المواد من الخارج ، وتتم إزالة جميع المنتجات التي تم إطلاقها من المنحل بالكهرباء. هذا يسمح لك بتنظيم عملية مستمرة.
خصائص الأداء الرئيسية لمصادر الطاقة الكيميائية
1. الجهد عبر المحطات المفتوحة
اعتمادًا على التصميم ، يمكن لمصدر واحد فقط إنشاء فرق محتمل معين. للاستخدام في الأجهزة الكهربائية ، يتم دمجها في البطاريات.
2. قدرة محددة
لبعض الوقت (بالساعات) ، يمكن لمصدر تيار كيميائي واحد توليد كمية محدودة من التيار (بالأمبير) ، والتي تنسب إلى وحدة من الوزن أو الحجم.
3. كثافة الطاقة
إنه يميز قدرة وحدة الوزن أو حجم مصدر التيار الكيميائي على توليد الطاقة الناتجة عن منتج الجهد بواسطة القوة الحالية.
4. مدة العملية
تسمى هذه المعلمة أيضًا تاريخ انتهاء الصلاحية.
5. قيمة التيارات التفريغ الذاتي
تؤدي هذه العمليات الجانبية للتفاعلات الكهروكيميائية إلى استهلاك الكتلة النشطة للعناصر وتسبب التآكل وتقلل من السعة المحددة.
6. سعر المنتج
يعتمد على التصميم والمواد المستخدمة وعدد من العوامل الأخرى.
أفضل مصادر التيار الكيميائي هي تلك التي لها قيم عالية من المعلمات الأربعة الأولى ، والتفريغ الذاتي والتكلفة منخفضة.
مبادئ شحن البطارية
بين مصادر التيار الكيميائي الثانوية ، فإنها تكتسب شعبية كبيرة. نماذج أيون الليثيوم ، التي أصبحت تستخدم على نطاق واسع لتشغيل الأجهزة الإلكترونية. يستخدمون LiMO2 (M Co ، Ni ، Mn) كمادة في القطب الموجب ، والجرافيت كما هو سلبي.
عند الشحن ، يتم إطلاق أيونات الليثيوم من الطاقة الخارجية المطبقة من المعدن الكاثودي ، وتمريرها عبر المنحل بالكهرباء وتخترق الفضاء بين طبقات الجرافيت ، وتتراكم هناك.
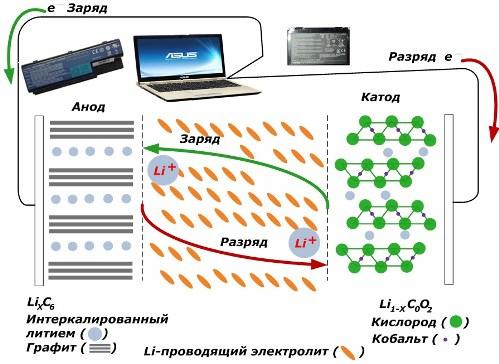
عندما الطاقة شاحن غائب ، ويتم توصيل الحمل إلى الأقطاب الكهربائية ، ثم تتحرك أيونات الليثيوم في المنحل بالكهرباء في الاتجاه المعاكس.
إذا لم يتم تنفيذ الشحن والتفريغ ، فلن يتم استهلاك الطاقة الموجودة في البطارية ، ولكن يتم تخزينها. لكن الكمية محدودة بخصائص المواد المستخدمة. على سبيل المثال ، في بطاريات الليثيوم أيون ، تبلغ السعة الكهربائية المحددة 130 m 150 مللي أمبير / ساعة. يقتصر على خصائص المواد الأنود. بالنسبة للجرافيت ، تبلغ السعة حوالي مرتين.
يبحث العلماء الآن عن طرق لزيادة سعة البطارية ، ويستكشفون إمكانية استخدام تفاعل كيميائي بين الليثيوم والأكسجين في الهواء. للقيام بذلك ، تم تطوير التصميمات باستخدام كاثود هواء غير مستهلك ، يُستخدم في بطاريات منفصلة. يمكن لهذه الطريقة زيادة كثافة الطاقة تصل إلى 10 مرات.
يتطلب تشغيل مصادر التيار الكيميائي المعرفة أساسيات الهندسة الكهربائية، الكيمياء الكهربائية ، علوم المواد وفيزياء الحالة الصلبة.
انظر أيضا في bgv.electricianexp.com
:
